基于 UV-C LED 的装置,用于对流式细胞仪中的鞘液进行连续去污
流式细胞仪鞘清洗新技术UV-C
UV-C模块
概览
无菌细胞分选具有挑战性,尤其是当流式细胞术细胞分选仪不在无菌环境中操作时。细胞分选仪的鞘液系统可能被细菌、酵母菌、病毒或真菌等细菌污染。因此,需要定期的化学清洗程序来准备分选机,通过冲洗流体系统进行无菌细胞分选。然而,这个过程很耗时,最重要的是,研究人员永远无法确定清洁过程是否成功。在这里,我们提出了一种方法,其中使用流通原理通过UV-C光照射来净化细胞分选仪的鞘液。利用这一原理,我们能够将鞘液中的细菌减少 5 个对数。
背景
流式细胞术细胞分选是生物医学研究实验室中的一项关键技术,用于根据细胞的生物学和物理特性分离细胞[1]。必须避免细胞分选仪用细菌、酵母菌、病毒或真菌等微生物污染分选细胞,以实现细胞培养或防止误导后续实验结果。
流式细胞术细胞分选仪通常不在无菌环境中运行,因此很有可能受到微生物污染,例如,当鞘液储液罐打开进行补充时。因此,需要基于次氯酸钠或乙醇的化学清洗程序来制备用于无菌细胞分选的细胞分选仪[2]。这样的过程非常耗时,更重要的是,操作员永远无法确定清洁过程是否成功[3]。此外,流体中清洁试剂的残留物会因毒性而对分选细胞造成伤害。
在许多细胞分选实验室中,将抗生素添加到分选细胞的收集培养基中,以防止细菌通过鞘液进入。反过来,这可能导致培养细胞的基因表达和调节水平发生不必要的变化,并影响后续结果[2]。此外,抗生素的广泛使用促进了耐药菌的发展[4,5]。
紫外线的致死作用[6]以灭活微生物而闻名。紫外光分为 UV-A (380–315 nm)、UV-B (315–280 nm) 和 UV-C (280–200 nm) 光谱区域。
UV-C 光的抗菌作用基于 DNA 吸收 200–280 nm 波长范围内的光子,导致嘧啶二聚体的形成,从而抑制 DNA 复制,从而阻断转录为 RNA [7]。UV-C 光可以由汞灯、脉冲氙灯或最近的 UV-C LED 产生。后者的尺寸非常小,需要低电流才能提供足以将水中细菌数量减少几个log10水平的UV-C剂量[8]。这些特性使得 UV-C LED 在流式细胞术细胞分选仪中对鞘液进行去污方面非常有趣,可替代基于化学去污的清洁程序。
在这里,我们提出了一种基于UV-C单元的方法,用于鞘液的流通照射,以实现无菌细胞分选。在一项原理验证研究中,UV-C 装置被放置在 BD Influx™ 细胞分选仪的鞘液罐和喷嘴之间(详细说明见补充数据)。该装置的净化效率是通过从实验室室内空气中获得的细菌进行的。
方法和结果
UV-C 装置(APE,柏林)由总体积为 60 ml 的蜿蜒不锈钢流体路径组成,其中鞘液由六个发射波长为 275 nm 的 UV-C LED(Luminus,XST-3535-UV-A60-CE275-00)照射。LED 位于每个通道转折点(图 1A)。施加到通过装置的鞘液的总 UV-C 剂量由 LED 电流、产生的 LED 辐射通量、LED 数量和鞘液在装置内的停留时间给出。通过改变 LED 电流和活动 LED 的数量,同时保持鞘液压力恒定,施加三种不同的 UV-C 剂量(图 1C)。通过简化计算获得预期剂量的粗略估计,并且可以在补充剂中找到 UV-C 剂量估计的详细描述。该计算假设紫外线辐射在自由空间中的传输。然而,由于流体路径中的光吸收和湍流,实际 UV-C 剂量很可能小于计算剂量。
实际应用
流式细胞术细胞分选仪的鞘液可能被增殖的微生物污染。我们的方法使用 UV-C 发光二极管 (LED) 来照射正在处理的细胞分选仪的鞘液。该程序可防止细菌污染对分选细胞的细胞培养的影响。
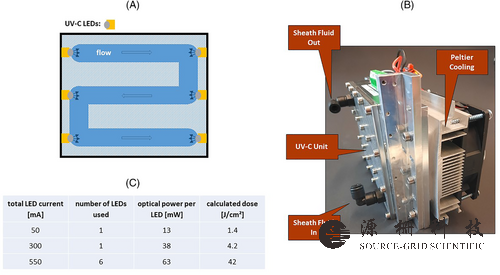
图1(A) UV-C LED 单元的俯视图。该装置的总体积为 60 毫升,由六个 UV-C LED 照射。这导致最大总 UV-C 剂量为 42 J/cm2护套液压力为 18 psi,LED 电流为 550 mA。通道横截面为 16 × 10 mm。 (B) 包括帕尔贴冷却装置在内的装置图片。整个单元的尺寸为 120 × 140 × 90 毫米。 (C) 产生三种不同 UV-C 剂量的 UV-C LED 参数。在18psi的鞘液压力下,所有剂量的鞘液在装置内的停留时间为10分钟。每个 LED 的光功率取自数据表
该装置配备了一个有源帕尔帖冷却元件(图 1B),以防止由于 UV-C LED 的功率耗散而导致鞘液发热。由于鞘液的粘度和密度发生变化,温度变化可能导致鞘液射流破碎成液滴的点位置发生变化(断裂点),这反过来又会影响分选细胞的纯度和产量[9]。在所有实验中,鞘液温度设定点均为15°C。
使用流式细胞术、固体培养基(LB琼脂)表征了UV-C单元灭活微生物的效率,以及在污染和辐照的鞘液中分选的Jurkat细胞的培养能力。为此,BD Influx™细胞分选仪的鞘液被铜绿假单胞菌污染,浓度为1.1×105细菌/毫升。
使用核酸染料 Syto9 和 PI 的流式细胞术分析结果如图 2 所示。由此产生的荧光模式反映了Syto9和PI与核酸的不同结合能力,这取决于施加的UV-C剂量和分析时间(图2A直接在辐照后,图2B在辐照后24小时)。随着 UV-C 剂量从 0 增加到 42 J/cm,Syto9 阳性群体的相对大小从 70.3% 减少到 1.15%2(图2A)。然而,如果样品在辐照后培养24小时并随后染色,则在UV-C辐照的样品中,Syto9阳性群体的相对大小从50.9%减少到0.02%(图2B)。这表明:(a)革兰氏阴性铜绿假单胞菌的外膜随着UV-C剂量的增加而日益受损[10-12],(b)UV-C光的破坏作用在照射后无法立即完全检测到。这可能表明修复机制不活跃或不够有效,无法在 UV-C 照射后使细菌生长。
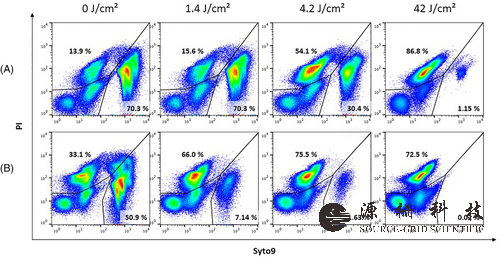
图2 铜绿假单胞菌的流式细胞术分析,以确定 UV-C 单元的效率。细胞分选仪的鞘液被铜绿假单胞菌污染,并用4种不同的UV-C剂量(0、1.4、4.2、42 J/cm)照射2).收集辐照和未辐照的鞘液,用核酸染料Syto9和PI染色,分析细菌细胞的膜完整性。在辐照后 (A) 立即或 (B) 24 小时分析样品。随着UV剂量的增加,直接染色样品的Syto9阳性群体的相对大小从70.3%下降到1.15%,照射后24 h染色的相对大小从50.9%下降到0.02%。左下门中的事件是流式细胞仪的背景和不能用核酸染料染色的颗粒
通过将辐照和非辐照鞘液接种在LB琼脂上来确认流式细胞术结果。对于施用的所有剂量,培养24小时后未检测到细菌菌落。因此,在所述配置中使用UV-C LED装置,对于所有应用剂量,铜绿假单胞菌可以减少5 log10,这符合细胞仪制造商建议的化学洗涤方案降低水平的有效性[2]。
在被铜绿假单胞菌污染的鞘液中对 Jurkat 细胞进行分选,以评估鞘液的 UV-C 照射对细胞培养能力的影响。分选后,即使施加最低的UV-C剂量为1.4 J / cm,细胞也可以培养至少72小时2.然而,如果鞘液没有被UV-C光照射,则在孵育后24小时内细胞培养物中长满了细菌。这证实了在LB琼脂上进行铺板实验确定的结果,其中最低UV-C剂量为1.4 J / cm2即使膜没有完全降解,也足以防止增殖,如核酸染色所示(图2)。
结论
根据计算出的剂量估计值,UV-C 装置的最大剂量为 42 J/cm2,这比实现铜绿假单胞菌减少 4 log10 所需的剂量高出约 5400 倍。因此,即使施加的UV-C剂量低于计算剂量,其他微生物,如酵母菌、真菌或病毒[6,11]也很可能通过建议的方法成功灭活。但是,如果需要更高的剂量,可以在装置中添加额外的 LED。根据我们的经验,大部分污染是在鞘液罐中引起的。因此,在水箱内使用UV-C LED也是可以想象的,但技术上更复杂。总体而言,所提出的UV单元能够有效地净化流式细胞分选仪中的鞘液,从而在随后的细胞培养中无需抗生素即可进行细胞分选。此外,它还有助于避免对细胞分选仪管路进行大量化学清洗。因此,对于依赖于在无抗生素环境中对分选细胞进行后续培养的研究,这是一种有价值的细胞分选方法

 售前咨询专员
售前咨询专员
